Arzneimittel
Anwendungsbegleitende Datenerhebung für Wirkstoff Fedratinib
Daten aus der klinischen Anwendung des oralen Januskinase-Inhibitors Fedratinib (Inrebic®) werden künftig flächendeckend über eine Registerstudie erfasst. Dazu hat der Gemeinsame Bundesausschuss (G-BA) den Hersteller verpflichtet und Anforderungen festgelegt. Durch die so erhobenen Daten soll eine aussagekräftige Bewertung des patientenrelevanten Zusatznutzens dieses Wirkstoffs möglich werden.
Die anwendungsbegleitende Datenerhebung gilt für den Einsatz des Wirkstoffs bei:
- Erwachsenen mit primärer Myelofibrose,
- Post-Polycythaemia Vera-Myelofibrose oder
- Post-Essentieller Thrombozythämie-Myelofibrose, die nicht mit einem Janus-assoziierten Kinase (JAK)-Inhibitor vorbehandelt sind und für die der Wirkstoff Ruxolitinib die patientenindividuell geeignete Vergleichstherapie darstellt.
Die Myelofibrose ist eine sehr seltene Krankheit, die aufgrund von Genveränderungen zu einer Wucherung des Gewebes im Knochenmark führt.
Die Datenerhebung zu Fedratinib soll vorzugsweise über das schon bestehende GSG-MPN-Register (German Study Group für Myeloproliferative Neoplasien) realisiert werden.
Als Vergleichstherapie für die Datenerhebung wurde vom G-BA der bereits seit 2014 zur Behandlung der Myelofibrose verfügbare Janus-Kinase-Inhibitor Ruxolitinib bestimmt.
Der Hersteller wird mit dem G-BA das Studienprotokoll und den statistischen Analyseplan abstimmen. Erst danach kann die Registerstudie starten.
Anwendung wird auf studienteilnehmende Ärztinnen und Ärzte eingeschränkt
- ab Start der Studie - Fedratinib nur noch von datenerhebungsteilnehmenden Ärzt:innen einsetzbar
- Startzeitpunkt nach Abstimmung des Studienprotokolls und des statistischen Analyseplans
- Feststellungsbeschluss voraussichtlich im Laufe des zweiten Halbjahres 2023
Die Beschlüsse dazu finden Sie hier und hier. Nähere Informationen zur anwendungsbezogenen Datenerhebung sind hier hinterlegt.
Versorgung mit Xevudy® – monoklonale Antikörper
Das Bundesministerium für Gesundheit teilt mit, dass seit dem 15. November 2022 der monoklonale Antikörper Xevudy® über die üblichen Vertriebswege des pharmazeutischen Großhandels und der Apotheken in den Verkehr gebracht wird.
Bis zu diesem Zeitpunkt sollten noch bevorzugt Arzneimittel aus den Beständen der Bundesregierung verwendet werden. Die Vergütung von Leistungen im Zusammenhang mit der Antikörpertherapie (GOP 88400, 88402 und 88403) erfolgt nur für diese vom Bund beschafften Einheiten.
Behandlungsleistungen, die sich aus der Anwendung eines über den regulären Beschaffungsweg erhaltenen Arzneimittels ergeben, werden bislang nicht vergütet. Die Beratungen hierzu dauern noch an.
Die Kosten des monoklonalen Antikörpers werden von den gesetzlichen Krankenversicherungen getragen.
Xevudy® wurde im Dezember 2021 zur Behandlung von Erwachsenen und Jugendlichen ab 12 Jahren mit einer COVID-19-Erkrankung zugelassen. Aktuell zeigt sich in vitro eine deutlich verminderte Wirksamkeit gegenüber den Omikron Varianten BA.2 und BA.4/BA.5. Der Einsatz wird derzeit von der Fachgruppe COVRIIN beim Robert Koch-Institut nicht zur Monotherapie einer COVID-19-Infektion empfohlen, sondern ggf. kann eine Anwendung in Kombination mit anderen Virostatika bei Patientinnen und Patienten mit relevanter Immunsuppression und/oder prolongierter Virusausscheidung im Einzelfall erwogen werden – publizierte Daten für die Kombinationstherapie liegen nicht vor.
Heilmittel
Diagnoseliste für langfristigen Heilmittelbedarf wird ab Januar 2023 erweitert
Der Gemeinsame Bundesausschuss (G-BA) hat die Liste jener Erkrankungen ergänzt, bei denen er davon ausgeht, dass Patient:innen einen langfristig, gleichbleibenden Heilmittelbedarf haben.
In die sogenannte Diagnoseliste für langfristige Heilmittelbedarfe wurden unter anderem weitere neuromuskuläre Erkrankungen sowie Mehrfachamputationen an Armen und Beinen aufgenommen.
Mit der Ergänzung der Diagnoseliste erweitert sich ab 1. Januar 2023 der Kreis der gesetzlich Versicherten, bei denen ein langfristiger Heilmittelbedarf von vornherein als genehmigt gilt.
Heilmittel, zum Beispiel Physio- und Ergotherapie, können so wiederholt für jeweils 12 Wochen verordnet werden.
Unnötige Arztbesuche und eine Unterbrechung der fortlaufend benötigten Heilmitteltherapie werden mit der Anerkennung des langfristigen Bedarfs vermieden.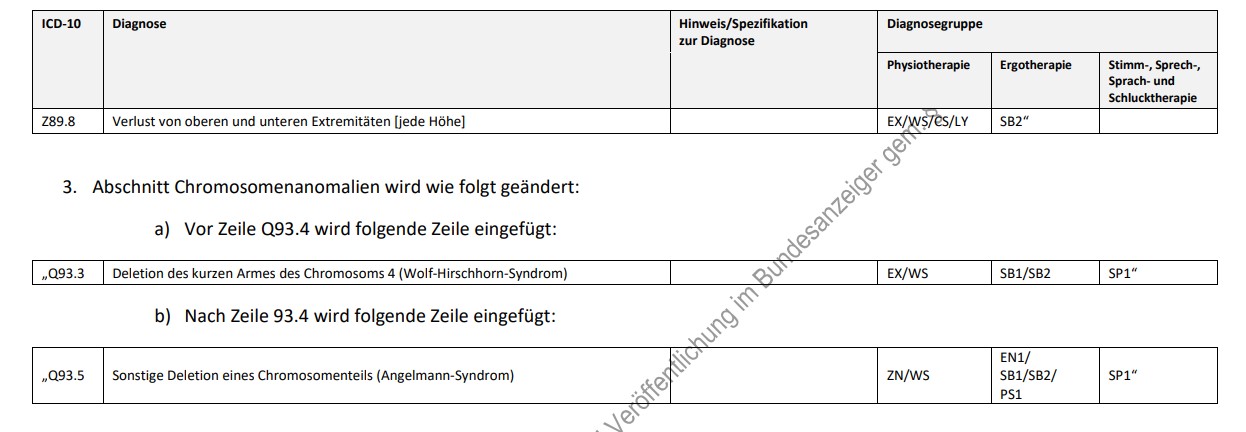
Die Liste der Diagnosen zum langfristigen Heilmittel,- und besonderen Verordnungsbedarf finden Sie hier auf der Seite der Kassenärztlichen Bundesvereinigung.
Mit Beschluss vom 15. September 2022 tritt die Änderung der Heilmittel-Richtlinie für die Ergänzung der Diagnoseliste zum langfristigen Heilmittelbedarf nach Veröffentlichung im Bundesanzeiger zum 01.01.2023 in Kraft. Die tragenden Gründe finden Sie hier.
Impfstoffe
Änderung und Anpassung der Schutzimpfungs-Richtlinie
Durch die aktualisierte Empfehlung der STIKO zur Gelbfieberimpfung als Reiseindikation beziehungsweise berufliche Indikation, hat der G-BA die Schutzimpfungs-Richtlinie angepasst.
Zuvor wurde bei der Reiseindikation und beruflicher Indikation eine einmalige Impfung als ausreichend erachtet. Zukünftig wird eine zweite Impfstoffdosis, sofern zehn Jahre oder mehr seit der Erstimpfung vergangen sind, verabreicht. Danach sind keine weiteren Auffrischimpfungen mehr notwendig.
Mit Beschluss vom 6. Oktober 2022 trat die Änderung der Schutzimpfungs-Richtlinie (SI-RL) für die Impfung gegen Gelbfieber nach Veröffentlichung im Bundesanzeiger zum 7. Dezember 2022 in Kraft. Die tragenden Gründe finden Sie hier.
Zudem hat der G-BA aufgrund des Pflegebonusgesetzes am 20. Oktober 2022 verschiedene Änderungen in der Schutzimpfungs-Richtlinie in Bezug auf die Durchführung von Schutzimpfungen durch weitere berechtigte Personen (zum Beispiel Grippeschutzimpfungen durch die Apotheken) beschlossen.
Bei Affenpocken war darüber hinaus eine Ergänzung der Anlage 2 erforderlich.
Mit Beschluss vom 20. Oktober 2022 trat die Änderung der Schutzimpfungs-Richtlinie (SI-RL): Anpassung Pflegebonusgesetz und Änderung Anlage 2 nach Veröffentlichung im Bundesanzeiger zum 20. Dezember 2022 in Kraft. Die tragenden Gründe finden Sie hier.
Meldung des Bedarfes an Influenza-Impfstoffen für die Saison 2023/2024
Bitte melden Sie Ihren voraussichtlichen Bedarf an Influenza-Impfstoffen für die Impfsaison 2023/2024, für gesetzlich Versicherte, ab jetzt über das Online-Portal der KV Berlin. Der Zugang erfolgt über die BSNR- beziehungsweise LANR-Anmeldung im Online-Portal.
Unter dem Menüpunkt „Umfrage Influenza-Impfstoff“ kann der voraussichtliche Influenza-Impfstoffbedarf pro BSNR bis zum 5. Januar 2023 gemeldet werden.
Bitte geben Sie Ihren Bedarf getrennt nach konventionellem und Hochdosis-Influenza-Impfstoff (Efluelda®) an. Bezüglich der Menge orientieren Sie sich bitte am Bedarf der letzten Saison, sofern sich hinsichtlich Zusammensetzung Ihres Patient:innenklientels, der Fallzahlen und der Praxisgröße keine Veränderungen ergeben haben.
Sofern Sie generell nicht impfen und Sie deshalb keinen Bedarf an Influenza-Impfstoffen haben, ist dies über das entsprechende Ankreuzfeld in der Online-Abfrage mitzuteilen.
Die Meldung des Influenza-Impfstoffbedarfes ist seit Inkrafttreten des TSVG am 11. Mai 2019 erforderlich. Die KV Berlin bündelt die Informationen und gibt Sie an die Kassenärztliche Bundesvereinigung weiter. Danach gehen die Bedarfsmeldungen aller KV-Bereiche an das Paul-Ehrlich-Institut, welches bis zum 15. März 2023 den Bedarf prüft und um rund zehn Prozent erhöht, um Engpässe zu vermeiden.
Mit Ihrer rechtzeitigen Meldung – unabhängig von der späteren Bestellung (wir informieren darüber im Dezember) – unterstützen Sie das Vorhaben, Engpässe in der Versorgung mit Influenza-Impfstoffen zu vermeiden.
Sprechstundenbedarf
Glukosetoleranztest als Fertigarzneimittel
Seit September 2022 bietet die medphano Arzneimittel GmbH eine Glucose-Fertiglösung an. Der „Valena Glucose-Toleranztest“ (PZN: 17874542) beinhaltet 300 ml fertige Lösung, wobei 100 ml Lösung 27,5 g Glucose-Monohydrat ≙ 25 g wasserfreie Glucose enthalten.
Die Lösung kann ab sofort als Sprechstundenbedarf, zur Diagnose oder zum Ausschluss eines Diabetes mellitus oder einer gestörten Glucosetoleranz, angefordert werden. Nach Genehmigung durch die AOK Nordost wird das ausgedruckte und von der Ärztin oder dem Arzt unterschriebene PDF in der Apotheke eingereicht.
Verfahren nach Rückmeldung der AOK Nordost über das KV-Portal
Aufgrund von Nachfragen informieren wir Sie, wie bei einer Rückmeldung zum Sprechstundenbedarf vorzugehen ist.
Sobald die SSB Bestellung von der AOK Nordost bearbeitet wurde, erhalten Sie die nachfolgend aufgeführte Benachrichtigung:
Um zu überprüfen, ob die APO-SSB oder NAPO-SSB bearbeitet wurde, loggen Sie sich bitte im Online-Portal der KV Berlin ein. Nach der Anmeldung sehen Sie in der Übersichtstabelle den Status Ihrer Bestellungen – diese sind grün hinterlegt, sofern die Rückmeldung der AOK Nordost erfolgt ist.

Die genehmigte NAPO- Bestellung erhalten Sie von dem Lieferanten, den die AOK Nordost ausgewählt hat. Bezüglich der APO- Bestellung ist es notwendig, dass Sie das PDF herunterladen, dieses ausdrucken, mit der ärztlichen Unterschrift und Stempel versehen und bei der anfangs ausgewählten Apotheke einlösen. Bitte beachten Sie, dass das genehmigte PDF nur innerhalb von vier Wochen, ab Genehmigungsdatum, von der Apotheke abgerechnet werden kann.
Kinderinjektionspflaster
Aufgrund vermehrter Anfragen stellen wir eine Übersicht mit Kinderinjektionspflastern, die sich im Lieferprogramm der AOK Nordost befinden und über den Sprechstundenbedarf bezogen werden können, zur Verfügung (Stand 31.10.2022):
- Dermaplast Kinderpflaster
- Elastus KidsStripe
- Gothaplast Kinderpflaster Blume od. Käfer
- Tattoo Kinderpflaster Gothaplast
- Trusetal Injektionspflaster Marienkäfer od. Spooky
- Hansa Kids Universalstrips
- Leukoplast Kids
- Rudaderm Junior
Wirtschaftlichkeitsprüfung
Durchschnittswerte für das Jahr 2020 verfügbar
Unter der Rubrik Wirtschaftlichkeitsprüfung auf der Website der KV Berlin sind ab sofort die Durchschnittswerte für die Verordnung von Arzneimitteln (einschließlich Verbandmitteln, Blutzuckerteststreifen sowie Trink- und Sondennahrung) und Heilmitteln für das Verordnungsjahr 2020 verfügbar.
Bitte beachten Sie, dass diese Durchschnittswerte das Verschreibungsverhalten aller zugelassenen Berliner Ärzt:innen Ihrer Vergleichsgruppe in 2020 widerspiegeln. Vor allem die SARS-CoV-2 Pandemie wird in 2021 und 2022 die Anzahl an Behandlungen und auch an Verordnungen beeinflussen. Darüber hinaus könnten auch Lieferschwierigkeiten bei verschiedenen Arzneimitteln und die Preiserhöhungen im Heilmittelbereich die Durchschnittswerte der darauffolgenden Jahre beeinflussen.
Die Bereitstellung von praxisbezogenen Auswertungen geben wir in den Verordnungs-News bekannt.
Regress bei Unter- oder Überschreiten von Zulassungsbestimmungen als off-label-use
Off-label-use- Verordnungen, ohne Genehmigungen der Krankenkassen, können zu Regressanträgen führen. Darüber haben wir bereits mehrfach informiert.
In letzter Zeit stellen wir zudem fest, dass auch Anträge auf Rückzahlung der entstandenen Arzneimittelkosten aufgrund von weiterführenden Bestimmungen innerhalb der Fachinformation von Krankenkassen gestellt werden.
Wir möchten Sie heute über drei Konstellationen informieren:
Beispiel 1: Altersbeschränkung in Zulassung:
- Arzneimittel ist nur für Erwachsene depressive Patient:innen zugelassen
- in der weiterführenden Zulassung (Dosierung) findet sich die Einschränkung auf Patient:innen <75 Jahren
- erfolgt die Verordnung bei korrekter Indikation für Patient:innen ab 75 Jahren besteht die Gefahr eines Regressantrages durch die Krankenkasse der Patient:innen
Lösung: Bitte prüfen Sie andere Verordnungsoptionen oder stellen Sie mit den Patient:innen einen Kostenübernahmeantrag bei der Krankenkasse!
Beispiel 2: Verschiedene Wirkstärken eines Arzneimittels mit unterschiedlichen Zulassungsindikationen:
Dabigatranhaltige Arzneimittel wie Pradaxa® beispielsweise sind in unterschiedlichen Wirkstärken und unterschiedlichen Indikationen zugelassen.
Verordnen Ärzt:innen beispielsweise aufgrund einer zuvor erfolgten Medikamenteneinstellung mit Therapieerfolg (zum Beispiel per Entlassmedikation), die 75 mg Stärke obwohl der oder die Patientin per Zulassungsdiagnose mit der 110 mg Stärke therapiert werden müsste, könnte die Krankenkasse einen Antrag auf vollständigen Ersatz der Arzneimittelkosten bezüglich einer Verordnung im off-label-use stellen.
Lösung: Antrag auf Kostenübernahme im off-label-use!
Beispiel 3: Dosierungsschema:
Ebenso von Regressanträgen durch Krankenkassen belegt, werden Verordnungen mit Dosierungsschema, welche nicht der Dosierung innerhalb der Fachinformation entsprechen.
Soll laut Fachinformation ein Arzneimittel beispielsweise nur morgens eingenommen werden und steht auf der Verordnung 1-0-1, so stellen Krankenkassen Regressanträge im off-label-use.
Hinweis! Alternativ zum direkt angegeben Dosierungsschema auf der Verordnung, ist auch die Angabe von Dj auf der Verordnung zulässig. Dies bedeutet, dass Sie den Patient:innen die Dosierung schriftlich mitgegeben haben.
Um Regressanträge zu verhindern, empfehlen wir Ihnen jede Verordnung, die einen zulassungsbedingten off-label-use darstellen würde, zuvor von der Krankenkasse Ihrer Patient:innen genehmigen zu lassen.
Grundsätzliche Informationen zum off-label-use und Informationen zur Antragsstellung finden Sie unter diesem Stichwort hier.
Sonstiges
Fahrten zu Gesundheitsuntersuchungen und Krebsfrüherkennungen
Nach Hinweisen aus der Versorgungspraxis hat der Gemeinsame Bundesausschuss (G-BA) am 20. Oktober 2022 eine Klarstellung in der Krankentransport-Richtlinie vorgenommen.
Im § 8 der Richtlinie wird per Ergänzung abgesichert, dass zu den von den gesetzlichen Krankenkassen übernommenen Fahrten von dauerhaft in ihrer Mobilität beeinträchtigten pflegebedürftigen und schwerbehinderten Personen zu ambulanten Behandlungen aus zwingenden medizinischen Gründen ausdrücklich auch Fahrten zu
- Gesundheitsuntersuchungen für Erwachsene und Kinder gemäß den §§ 25 und 26 SGB V sowie
- Krebsfrüherkennungsuntersuchungen einschließlich den organisierten Krebsfrüherkennungsprogrammen gemäß den §§ 25 und 25a SGB V
gehören.
In der Vergangenheit kam es offenbar in der Praxis zu unterschiedlichen Auslegungen. Diese betrafen zum Beispiel Fahrten zu organisierten Krebsfrüherkennungsprogrammen, wenn diese zum Beispiel durch eine zentrale Einladungsstelle organisiert und vereinbart wurden. Mit der Klarstellung will der G-BA sichergehen, dass auch Versicherte mit einer dauerhaft eingeschränkten Mobilität – beispielsweise durch eine Behinderung oder Pflegebedürftigkeit – einen Zugang zu Früherkennungsangeboten erhalten.
Die Krankenfahrt zu einer Gesundheits- oder Krebsfrüherkennungsuntersuchung kann für Versicherte verordnet werden, die einen Schwerbehindertenausweis mit dem Merkzeichen „aG“, „Bl“ oder „H“ oder einen Einstufungsbescheid gemäß Sozialgesetzbuch XI in den Pflegegrad 3, 4 oder 5 vorlegen und bei einer Einstufung in den Pflegegrad 3 wegen dauerhafter Beeinträchtigung ihrer Mobilität einer Beförderung bedürfen. Zudem sind die Verordnungsvoraussetzungen auch bei Versicherten erfüllt, die bis zum 31. Dezember 2016 in die Pflegestufe 2 eingestuft waren und seit 1. Januar 2017 mindestens den Pflegegrad 3 erhalten haben.
Das Einholen einer Genehmigung der Verordnung durch die Krankenkasse ist nicht erforderlich, wenn die Krankenfahrt beispielsweise mit einem Taxi oder Mietwagen verordnet wird. Ist während der Fahrt eine medizinisch-fachliche Betreuung oder eine fachgerechte Lagerung der Patientin oder des Patienten notwendig, muss für die Krankenfahrt mit dem Krankentransportwagen vorab eine Genehmigung eingeholt werden.
Die Klarstellung ist nach Veröffentlichung im Bundesanzeiger zum 11. Januar 2023 in Kraf getreten.
Die gesamte Klarstellung des G-BA vom 20. Oktober 2022 finden Sie hier.
Grundsätzliches zur Krankenbeförderung können Sie auf der Website des G-BA nachlesen.
Sonstige veranlasste Leistungen
.
Corona-Sonderregelung – Telefonische Krankschreibung bei leichten Atemwegserkrankungen weiter bis Ende März 2023 möglich
Der Gemeinsame Bundesausschuss (G-BA) hat seine Corona-Sonderregelung zur telefonischen Krankschreibung bis 31. März 2023 verlängert. Ohne diesen Beschluss wäre die Sonderregelung zur Bescheinigung einer Arbeitsunfähigkeit zum 30. November 2022 ausgelaufen.
Nun gilt weiterhin: Versicherte, die aufgrund einer leichten Atemwegserkrankung arbeitsunfähig sind, können nach telefonischer Anamnese bis zu sieben Tage krankgeschrieben werden.
Vorgehen: Niedergelassene Ärzt:innen befragen die Patient:innen am Telefon zu ihren Beschwerden und bescheinigen dann gegebenenfalls die Arbeitsunfähigkeit. Eine Verlängerung der Krankschreibung auf telefonischem Wege ist einmalig für weitere sieben Kalendertage möglich.
Alle befristeten Sonderregelungen des G-BA im Zusammenhang mit der Coronavirus-Pandemie des G-BA finden Sie hier.
Verlängerung COVID-19-Schutzgesetz
Die Gültigkeit von SARS-CoV-2-AMVV und MAK-VO wurde bis zum 7. April 2023 verlängert.
Dies betrifft folgende Themenbereiche:
- Bestehende Regelungen für Beschaffung und Inverkehrbringen bestimmter Arzneimittel, Erstattungsfähigkeit zur Präexpositionsprophylaxe, Vergütung und Distribution zentral beschaffter Arzneimittel gelten weiter
- Coronavirus-Impfverordnung:
- Verlängerung der Gültigkeit „nur“ bis 31. Dezember 2022
- Einzelne Regelungen (zum Beispiel Vergütung) sollen nach Aussage des Bundesgesundheitsminiseriums (BMG) darüber hinaus verlängert werden.
- Der G-BA hat bereits ein Stellungnahmeverfahren zur Übernahme der Impfungen gegen COVID-19 in die Schutzimpfungs-Richtlinie eingeleitet.
Änderungen in der Impfdokumentation
Anstelle des Beginns oder des Abschlusses der Impfserie (Erst-, Folge- oder Auffrischimpfung) ist „die genaue Stellung der Impfung in der Impfserie“ anzugeben.
Abrechnung
Bisherige Suffixe bleiben, zum Beispiel A für 1. Impfung, B für 2. Impfung, R für 3. Impfung beziehungsweise weitere Impfung.
Ab der 3. Impfung ist in Feld 5009 anzugeben, ob zum Beispiel die 3. oder 4. Impfung vorgenommen wurde (siehe hier).
Verlängerung der Verordnungsfähigkeit von Medizinprodukten (AM-RL, Anlage V)
Die nach der Arzneimittel-Richtlinie (AM-RL) zulasten der gesetzlichen Krankenversicherung verordnungsfähigen Medizinprodukte, inklusive medizinisch notwendiger Fälle sowie der jeweiligen zeitlichen Befristung für die Erstattung, sind in der Anlage V der AM-RL aufgeführt. Dies gilt auch für versicherte Kinder bis zum vollendeten 12. Lebensjahr und versicherte Jugendliche mit Entwicklungsstörungen bis zum vollendeten 18. Lebensjahr. Für folgende Produkte wurde die Verlängerung der Befristung der Verordnungsfähigkeit vorgenommen:
- NYDA® neu befristet bis zum 27. Mai 2024
- NYDA® Läusespray neu befristet bis zum 27. Mai 2024
Onlineseminare für neue Ärzt:innen im Dezember 2022
Für Ärzt:innen, deren Teilnahmebeginn an der vertragsärztlichen Versorgung noch nicht allzu lange zurückliegt oder kurz bevorsteht, bieten wir zwei thematisch geteilte Informationsveranstaltungen zu den vielfältigen und teils komplexen Regelungen rund um die Verordnung, sowie zum Thema der elektronischen Bestellung des Sprechstundenbedarfs (SSB) an.
Das Seminar I (13. Dezember 2022 von 18-20 Uhr) umfasst die Themen:
- Arzneimittel
- Impfstoffe
- Sprechstundenbedarf
- Wirtschaftlichkeitsprüfung
Die Anmeldung ist unter diesem Link möglich.
Das Seminar II (15. Dezember 2022 von 18-20 Uhr) umfasst die Themen:
- Heilmittel
- Hilfsmittel
- sonstigen Leistungen
- Wirtschaftlichkeitsprüfung
Die Anmeldung ist unter diesem Link möglich.
Das Seminar III (14. Dezember 2022 von 16-17 Uhr) umfasst die SSB-Themen:
- elektronisches Bestellverfahren, inkl. Live-Vorführung
- anforderungsfähige Artikel
- Tipps und Hinweise
Für dieses Seminar können Sie und auch Ihr Praxispersonal Ihre Anmeldung unter diesem Link vornehmen.
Die Teilnahme an den Seminaren ist kostenfrei. Fortbildungspunkte oder Teilnahmezertifikate werden nicht vergeben.


